
물질의 상태에 대해서 배운 적이 있을 겁니다. 구성하는 원자나 분자들이 기체에 비해 어느 정도 상호작용하며 유동성을 가지는 상태를 액체라고 하고, 그보다 강한 결합으로 단단히 고정되어 유동성이 거의 관찰되지 않는 상태를 고체라고 합니다.
그런데 고체에도 종류가 있습니다. 고체 중에서 매우 높은 질서로 원자들이 정해진 자리를 지키며 반복적으로 배열된 고체를 단결정이라고 하고, 결정성은 갖지만 작은 결정들이 모여 하나의 큰 덩어리를 이루는 고체를 다결정이라고 합니다. 한편 원자들이 질서 없이 무작위적으로 배열된 고체도 있는데, 이를 비정질라고 하며, 유리가 해당합니다.

유리는 일반적으로 모래의 주성분인 규산염 중 이산화규소(SiO₂)를 다른 금속 산화물과 혼합한 뒤 고온에서 가열해 녹인 다음 초당 500°C를 낮추는 속도로 급속 냉각시켜 만듭니다.
서서히 냉각시키면 안 되는 이유는 이산화규소(SiO₂)와 다른 성분들이 규칙적인 배열을 형성할 시간을 주어 다결정이 만들어질 수 있기 때문입니다. 그러면 각 결정 사이에 틈이 생기고, 물질 내부에서 당기거나 미는 힘의 차이가 발생해 쉽게 파손됩니다.
여기서 다른 물질도 비정질 고체로 만들 수 있지 않을까 하는 궁금증이 생길 수 있는데, 액체인 물이 얼면 고체인 얼음이 됩니다. 이 과정은 필연적인 것 같으나 물을 초당 10만℃를 낮추는 속도로 급속 냉각하면 물도 유리와 같은 비정질 고체가 될 수 있습니다. 이처럼 규산염 물질만이 유리가 될 수 있는 것은 아니며, 유리와 같은 상태의 물질을 유리질이라고 합니다.
비정질 고체 구조는 유리에 중요한 특성을 부여합니다. 빛이 물체에 닿으면 빛은 물체에 흡수되거나 부딪혀 반사되거나 뚫고 투과하는 세 가지의 반응을 보입니다.
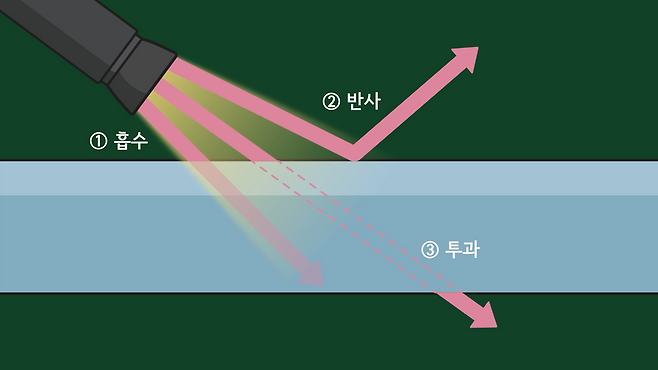
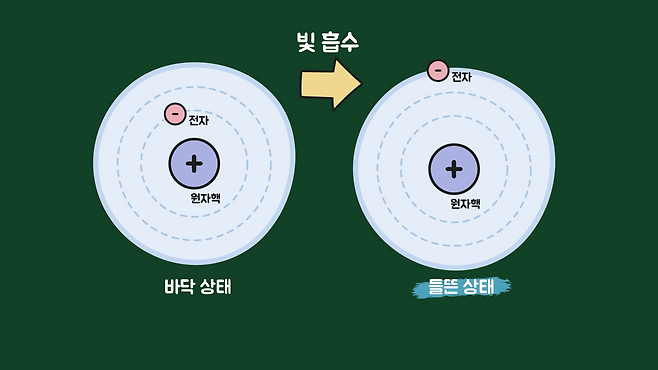
모든 물질은 원자로 이루어져 있으며, 원자 안에는 전자가 존재합니다. 전자는 특정한 에너지 준위에 위치해있고, 에너지가 높은 빛이 들어오면 빛에너지가 전자를 더 높은 준위로 이동시키려고 합니다. 이를 들뜬 상태라고 하고, 이 경우는 빛의 흡수가 일어납니다.
그런데 에너지 준위의 간격이 너무 작거나 크면 눈으로 볼 수 있는 특정 에너지 범위(1.65eV~3.26eV)의 빛인 가시광선 영역에 흡수되지 않고 투과합니다.
만약 유리가 결정성이 뛰어나 원자의 배열이 규칙적이었다면 각 원자의 에너지 준위들이 겹쳐져 하나의 두꺼운 띠(band)를 만들고, 가시광선을 비롯한 여러 빛이 흡수되어 전자를 들뜨게 하는 데 사용됐을 겁니다.
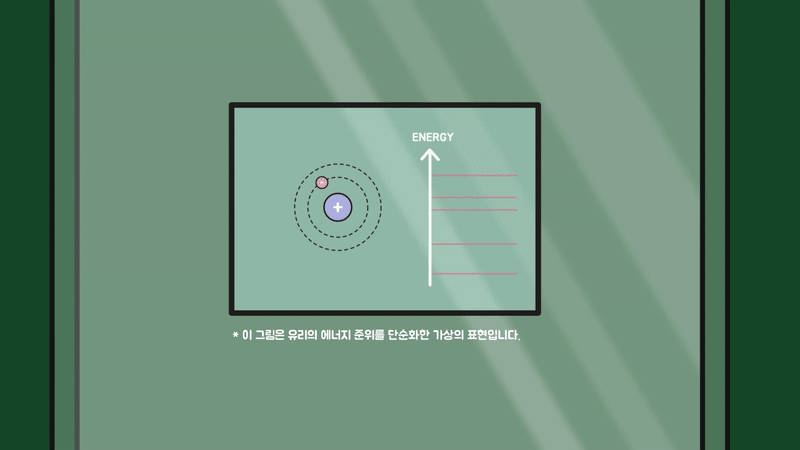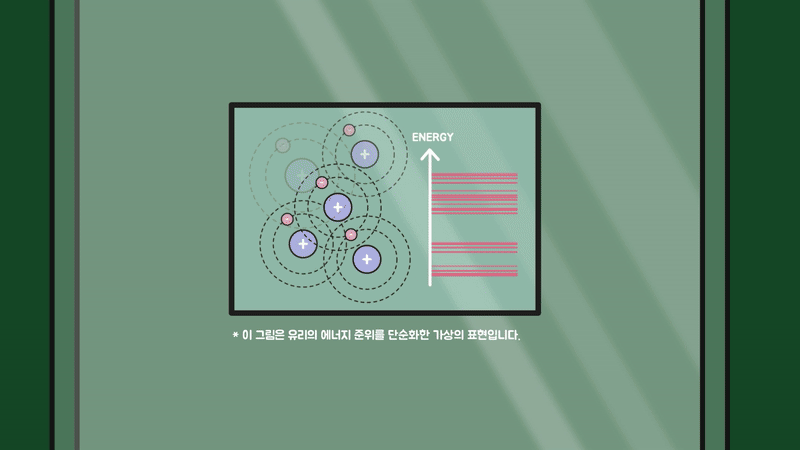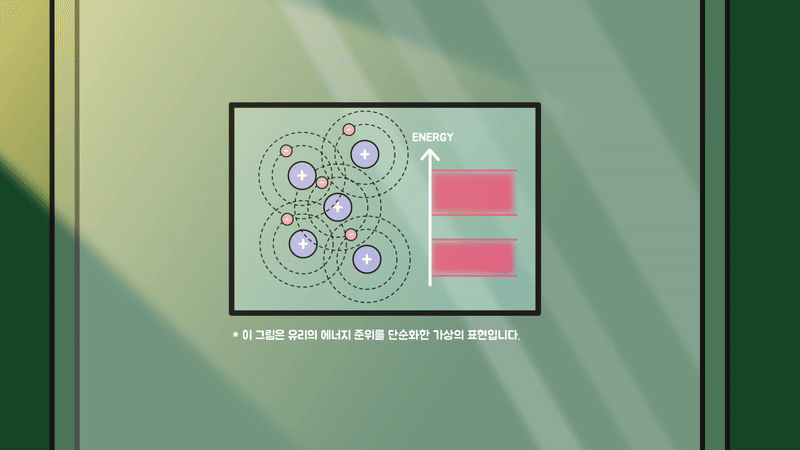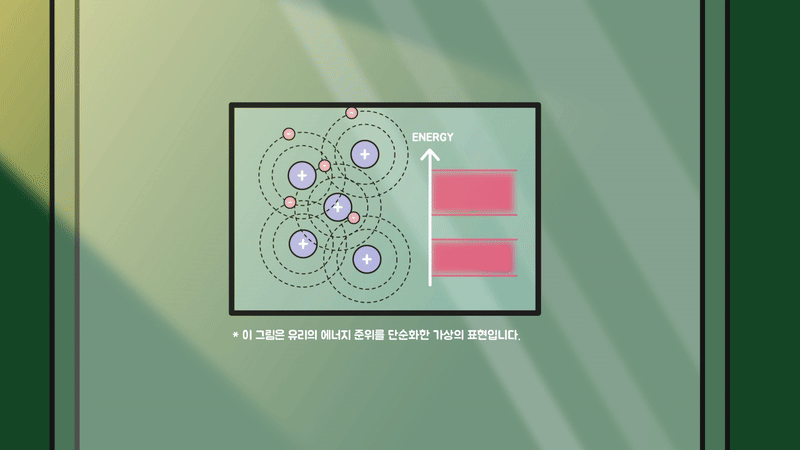
하지만 유리는 규칙성이 존재하지 않는 비정질 구조라서 원자의 에너지 준위들이 서로 겹치지 않고 불규칙하게 분포하기에 가시광선이 흡수될 수 없어 투명한 물질이 됩니다.
여기서 오해하면 안 될 것은 공기나 물과의 투명과는 전혀 다른 원리입니다. 빛은 투명한 물질을 투과할 때 물질에 따라 속도가 달라집니다. 공기를 1.00이라고 할 때 물은 1.32이고, 일반적인 유리는 1.52라는 굴절률을 갖는데, 굴절률이 높다는 의미는 빛이 투과하는 과정에서 굴절이 일어나 상대적으로 느리게 이동한다는 뜻입니다.

즉, 유리는 빛을 흡수하지 않고 투과시키면서도 굴절률이 높아 빛을 모으거나 분산시킬 수 있는 특유의 광학 효과를 가진 투명 물질이라는 겁니다.
유리가 망원경이나 현미경 등의 렌즈 제조에 사용되는 이유이고, 역사적으로도 항해나 관측 기술의 발달, 미세 생명체의 발견, 천체 관측을 통한 물리학과 실험 과학의 발달에도 크게 기여한 셈입니다.

그런데 이런 특성 때문에 단점도 명확합니다. 바로 쉽게 깨지는 것으로 결정성이 있는 물질은 원자들이 규칙적으로 배열된 결정면이 존재해서 외부에서 힘이 가해질 때 면을 따라 힘을 분산시킬 수 있습니다.
이와는 달리 유리와 같은 비정질 고체는 원자들이 불규칙적으로 배열되어 결정면이 없습니다. 따라서 힘이 가해질 때 쉽게 깨질뿐더러 전체가 연쇄적으로 깨지기 쉽습니다. 여기까지 주제의 궁금증은 해결했는데, 투명한 유리에 색을 입히는 원리도 궁금하지 않으신가요?
유리의 또 흥미로운 점은 제조 과정에서 불순물이 포함됐을 때 새로운 특징이 나타난다는 점입니다. 분명 순수한 규산염(SiO₂)으로 이루어진 석영 유리는 우수한 내구성과 더 높은 투명도를 갖긴 하지만, 최소 1,700℃ 이상의 온도가 가해져야 녹기 시작하므로 일반적인 유리 제조에는 어려움이 있습니다.

그래서 탄산나트륨(Na₂CO₃)과 석회(CaO)를 혼합해 더 낮은 온도에서 녹으며 유리화가 이루어질 수 있도록 만든 소다석회 유리가 일반적으로 사용됩니다.
이외에도 붕소를 넣어 내열성을 향상시킨 붕규산 유리가 있고, 알루미늄 산화물을 섞어서 내구성을 높이고 섬유 형태로까지 만들어낸 알루미늄 규산염 유리와 산화 납(PbO)을 넣어 광택과 굴절률이 높은 납 유리 등 다양합니다.
이는 유리에 색을 입힐 때도 응용됩니다. 오래된 유럽 성당의 창문을 보면 유리창이 굉장히 화려한데, 스테인드글라스 또는 색 유리창이라고 하고, 유리에 다양한 중금속 원소를 섞어서 만듭니다.

자세히 설명하기에 앞서 유리는 무슨 색일까요? 유리를 순수한 규산염으로 만들면 확실히 투명하므로 색이 없습니다. 하지만 일반적인 제조 과정에서 약간씩의 불순물이 포함될 수밖에 없는데, 지각에 다량 존재하는 철이 2가 양이온 상태(Fe²⁺)로 제조 시 함유되곤 합니다.
철 이온 본연의 색은 초록색이라서 유리는 연한 초록색이 기본적이 색상이고, 이해하기 쉽게 초록빛의 소주병이 별도 처리를 하지 않은 순수한 유리의 색이라고 할 수 있습니다.
만약 더 짙은 초록빛을 만들고 싶다면 2가 철 이온(Fe²⁺)을 더 넣어주면 되고, 광택이 나는 진한 녹색을 원한다면 3가 크로뮴 이온(Cr³⁺)을 넣어주는 방식으로 색을 조절할 수 있습니다.

그렇다면 반대로 초록색의 유리를 투명하게 만드는 방법은 없을까요? 철 이온을 제거하는 것은 복잡하고 비경제적이라서 유리 탈색제를 넣어 화학 반응으로 철의 산화수를 바꾸는 방법을 쓰고, 소량의 망가니즈(또는 주석) 산화물을 넣어주면 산화환원반응을 통해 철 이온을 변화시킬 수 있습니다.
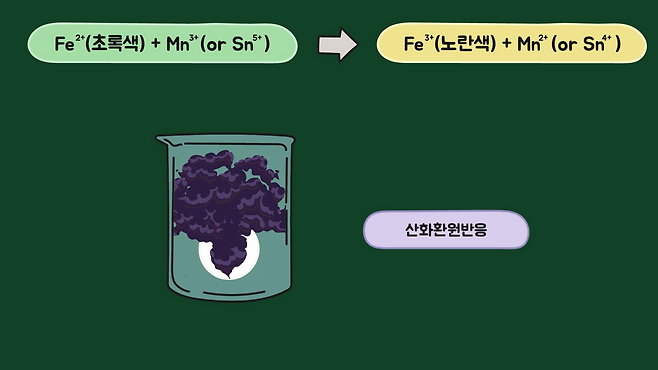
망가니즈를 넣으면 3가 철 이온(Fe³⁺)이 되고, 색이 충분히 옅어 초록색이 사라집니다. 더 투명에 가까운 상쾌한 하늘색을 얻고 싶으면 2가 구리 이온(Cu²⁺)을 조금 넣어주면 됩니다.
참고로 탈색을 많이 시키고 싶어서 망가니즈를 많이 넣으면 보라색 유리가 만들어지는데, 망가니즈(Mn) 대신 주석(Sn)을 많이 넣으면 불투명에 가까운 하얀색 유리가 만들어집니다.
이외에도 맥주병과 같은 호박색을 내고 싶다면 황과 탄소, 3가 철 이온(Fe³⁺)이나 녹인 철을 조금 넣고 혼합해주면 되고, 산화 코발트(CaO)를 넣으면 선명한 파란색을 만들 수 있습니다.
이런 원리에 따라 스테인드글라스는 꾸준히 발전하다가 르네상스 시대를 통해 근세로 들어서면서 쇠락합니다. 종교 중심에서 인간 중심적으로 인식이 변하면서 건축 양식도 변해 창의 크기는 줄어들고, 첨탑과 채광층(clerestory)이 사라지며 스테인드글라스를 쓰지 않았기 때문입니다.

사실 가장 큰 요인은 유화가 발달하고 보급된 것인데, 유리에 무언가를 하는 것보다 벽이나 천장에 붓으로 그림을 그리는 것이 빠르고 가격도 저렴했습니다. 즉, 새로운 건축 양식의 변화와 함께 쇠락한 겁니다.
또 시기적으로 성당과 교회의 스테인드글라스는 프랑스 대혁명과 영국의 종교개혁 과정에서 수도원이 해체되며 철거되어 점차 사라지기도 했습니다.

그러다가 19세기에 들어서며 신고전주의(Neoclassical)의 시작으로 스테인드글라스의 복원과 재조명이 시작됩니다. 이 과정에서 외젠 비올레 르 뒥(Eugène Emmanuel Viollet-le-Duc)에 의해 노트르담 대성당, 생트 샤펠, 생드니 대성당 등이 복원됐고, 스테인드글라스가 전 유럽에서 재건되며 이후 미국에서 변혁의 시대를 맞이합니다.

그리고 중세와 근세를 넘어 근대에 들어서면서는 새로운 미술이라는 의미의 아르누보(Art Nouveau) 시대가 열리는데, 티파니 유리가 유행합니다. 대표적으로 <벚꽃과 소녀>라는 작품이 있는데, 모든 티파니 유리 기술이 포함된 작품입니다.

모래에서 얻어지는 규소로 만든 유리에 역사적이고 과학적인 내용이 포함됐다는 것이 흥미롭습니다. 궁금증이 해결되셨나요?
- 원고 : 도서 <역사가 묻고 화학이 답하다>, 저자 : 광운대학교 화학과 장홍제 교수