“난치성 질환 정조준”… K-제약·바이오, 임상 2상이 수출 분수령
후속 개발 및 라이선스 아웃 통해 국내 업계 체질 전환도 주목

22일 업계에 따르면 국내 주요 제약·바이오 기업들은 항암제와 알레르기·퇴행성 뇌질환 등 다양한 파이프라인에서 임상 2상 단계 진입과 환자 투약에 잇따라 나서고 있다. 임상 2상은 실제 환자들을 대상으로 약효(유효성)와 적정 용량을 처음 검증하는 단계로 신약의 상업적 가치를 가늠하는 개념 증명 단계에 해당한다.
유한양행은 항면역글로불린E 계열 Fc 융합단백질 신약 후보물질 ‘레시게르셉트’의 만성 자발성 두드러기(CSU) 환자 대상 다국가 임상 2상을 본격화했다. 유한양행은 미국 국립보건원(NIH) 산하 임상정보 사이트에 임상 계획을 등록하고 한국·일본·중국·불가리아·폴란드 등 5개국에서 CSU 환자 150명을 대상으로 레시게르셉트 또는 위약을 12주간 투여해 안전성과 유효성을 평가할 계획이다. 1차 평가변수는 12주 시점 UAS7(7일간 두드러기 활성 점수) 변화이며 2027년 4분기 톱라인 결과 도출을 목표로 하고 있다.
레시게르셉트는 앞선 임상 1상에서 기존 표준요법인 오말리주맙 대비 더 강하고 오래 지속되는 혈중 유리 IgE 억제 경향을 보였으며 UAS7 기반 평가에서도 증상 개선 신호가 확인된 바 있다.
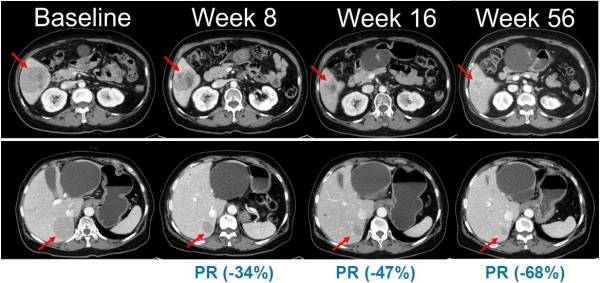
한미약품은 악성 피부암인 흑색종 치료를 위한 경구용 표적 항암신약 ‘벨바라페닙’의 국내 임상 2상 시험에서 첫 환자 투약을 완료하며 개발 속도를 높이고 있다.
한미약품은 지난 1월 식품의약품안전처로부터 임상시험계획(IND)을 승인받은 뒤 지난 12일 국내 대학병원에서 NRAS 돌연변이를 가진 국소 진행성 또는 전이성 흑색종 환자를 대상으로 첫 환자 투약을 마쳤다. 이번 임상 2상은 총 45명을 대상으로 벨바라페닙과 MEK 억제제 ‘코비메티닙’ 병용요법의 유효성과 안전성을 평가하는 다기관, 단일군 시험으로 설계됐다.
벨바라페닙은 종양 세포 성장에 관여하는 MAPK 경로 가운데 RAF·RAS 유전자 돌연변이를 표적하는 경구용 표적 항암제다. 기존 BRAF 억제제가 주로 단일체에만 작용하는 것과 달리 벨바라페닙은 BRAF와 CRAF 이합체까지 억제하도록 설계돼 내성 문제를 줄이고 더 넓은 변이 환자군을 포괄할 수 있을 것으로 기대된다.
특히 국내외 허가된 표준 치료제가 없는 NRAS 돌연변이 흑색종을 겨냥하고 있어 임상 2상에서 의미 있는 항종양 효능이 입증될 경우 글로벌 희귀암 시장에서의 상업적 가치가 크다는 평가다.
에이비엘바이오도 파트너사와 함께 항암·퇴행성 뇌질환 분야에서 임상 2상 구간에 진입하며 존재감을 키우고 있다.
에이비엘바이오는 위암 분야에서 클라우딘18.2·4-1BB 이중항체 ‘ABL111’를 글로벌 파트너 노바브릿지 바이오사이언스와 함께 전이성 위암 1차 치료제 후보로 임상 2상 첫 환자 투약을 시작했다. ABL111은 앞선 임상 1b상에서 위암 환자 대상 객관적 반응률(ORR) 70% 이상, 질병통제율(DCR) 100%를 기록하며 베스트 인 클래스 잠재력을 인정받기도 했다.
전문가들은 올해를 기점으로 국내 선도 제약·바이오 기업들이 단순 기술수출에서 나아가 실제 임상 2상 데이터로 글로벌 경쟁력을 입증해야 하는 단계에 진입했다고 진단한다.
특히 기존 치료 옵션이 제한적인 난치성 질환에서 의미 있는 결과가 도출될 경우 후속 3상 개발과 추가 라이선스 아웃, 상업화가 잇따르며 국내 제약·바이오의 체질 개선을 이끌 수 있다는 관측도 나오고 있다.