[강석기의 과학카페] 암과의 전쟁 '게임체인저' 나왔나

"라스(Ras)를 길들이지 못하면 암과의 전쟁에서 이길 수 없다." - 지데온 볼랙, 차오 장
1960년 미국의 존 F. 케네디 대통령이 연설에서 아폴로 계획을 언급했을 때 진지하게 생각한 사람은 많지 않았다. 그러나 불과 9년이 지난 1969년 우주인이 달에 첫발을 디디자 세계가 환호하며 현대 과학기술의 힘을 실감했다.
1971년 미국의 리처드 닉슨 대통령이 ‘국립 암법’에 서명하며 암과의 전쟁을 선포했을 때 많은 사람이 희망에 들떴다. 달에 사람을 보낸다는 불가능해 보이는 미션을 성공하는 데 10년이 안 걸렸으니 과학자들이 작정하고 암에 덤비면 10년, 늦어도 20세기가 끝나기 전(임상시험에 시간이 꽤 걸리므로) 암을 정복할 수 있지 않을까.
그러나 50년 넘게 지난 현재도 암은 여전히 무서운 질병으로 남아있다. 물론 조기 검진과 최신 영상기법의 도움을 받는 정밀한 수술, 새로운 항암제 개발 또는 여러 약물을 병행하는 칵테일 요법 등으로 전반적인 생존율은 꾸준히 올라가고 있다.
그런데 개별 암에 따라 성적에 차이가 크다. 예를 들어 만성골수성백혈병 환자의 생존율은 14%에서 95%로 극적으로 올라갔다. 제품명 글리벡인 신개념 항암제가 나온 덕분이다. 반면 췌장암은 여전히 10%대를 벗어나지 못하고 있다. 이는 암 유형에 따라 발병 메커니즘이 다르기 때문이다.
사실 암은 ‘유전자 돌연변이로 통제를 벗어나 증식하는 세포의 무리’라는 특성을 공유한 100가지가 넘는 개별 질환의 통칭이다. 오늘날 대다수 암의 발병 메커니즘이 밝혀졌지만 이 가운데 효과적인 치료법을 찾은 암은 정복에 가까운 상태이고 그렇지 못한 암은 여전히 고전 중이다.
● 1982년 첫 종양유전자 발견
암 관련 유전자는 두 가지 부류로 나뉜다. 먼저 원종양유전자(proto-oncogene)로 정상적인 세포의 성장과 분열에 관여한다. 그런데 돌연변이로 활성이 커지거나 지속되면 세포가 통제를 벗어나 증식하게 하는 종양유전자(oncogene)가 된다. 다음은 종양억제유전자로 세포의 성장과 분열을 억제하는 작용을 한다. 그런데 변이로 망가지면 역시 세포가 통제를 벗어난다.
자동차로 비유하자면 원종양유전자는 가속페달, 종양억제유전자는 브레이크페달이다. 운전을 하다 발을 떼도 가속페달이 제자리로 돌아오지 않거나 브레이크페달이 안 밟히거나 또는 두 가지 상황이 겹치면 얼마 못 가 사고가 나기 마련이다.
지금까지 밝혀진 암 관련 유전자는 100여 개에 이른다. 이 가운데 처음 밝혀진 두 유전자가 HRAS(에이치라스로 발음)와 KRAS(케이라스)로 1982년 거의 동시에 발견했다. 방광암으로 사망한 사람의 암세포에서 찾아낸 HRAS 유전자와 폐암세포에서 분리한 KRAS는 둘 다 변이로 염기가 하나 바뀌면서 산물인 단백질의 아미노산도 하나 바뀐 상태였다.
그 결과 원종양유전자가 종양유전자로 바뀌며 결국 암세포가 된 것이다. 두 유전자는 염기서열이 꽤 비슷하고 그 뒤 발견된 NRAS(엔라스) 유전자와 함께 RAS(라스) 유전자로 불린다.
세포막 안쪽에 붙어있는 라스 단백질은 세포 성장과 분열 신호 경로에서 스위치 역할을 한다. 평소에는 꺼진(off) 상태로 있다가 세포밖에서 신호가 오면 구조가 바뀌어 켜지며(on) 세포핵 게놈으로 신호를 전달하고 원래 구조로 돌아가 꺼지며 다음 신호를 기다린다. 이 과정은 매우 교묘하게 조절되는데 암이 보여주듯이 다세포 생물에서 개별 세포의 일탈은 치명적이기 때문이다.
비활성(off) 상태의 라스 단백질에는 GDP라는 분자가 붙어있다. 그런데 성장·분열 신호가 오면 GDP가 떨어져 나가고 GTP(GDP에 인산기가 하나 더 붙은 분자)가 들어오면서 라스 단백질 구조가 바뀌어 활성(on) 상태가 돼 신호를 전달한다. 흥미롭게도 활성 라스 단백질은 동시에 GTP에서 인산기를 떼어내 GDP로 바꾸는 활성도 있다. 그 결과 자신의 구조도 원래대로 바뀌며 비활성 상태로 돌아간다.
그런데 변이 라스 단백질은 GTP를 GDP로 바꾸지 못한다. 그 결과 GTP가 붙어 활성형이 되면 스위치가 켜진 상태로 머물며 성장·분열 신호를 계속 보내 결국 세포가 통제를 벗어나는 것이다. 1988년에서 1990년에 걸쳐 비활성 및 활성 라스 단백질 구조를 밝혀 이 메커니즘을 제안한 과학자가 바로 버클리 캘리포니아대 화학과 김성호 교수다.

● 치료제를 만들 수 없는 단백질로 불려
놀랍게도 암의 30%에서 변이 라스 단백질이 관여하는 것으로 밝혀졌다. 특히 췌장암은 90%나 되고 폐암과 대장암에서도 비율이 높다. 반면 유방암에서는 3%가 안 될 정도로 드물다. 이쯤 되면 짐작하겠지만 변이 라스 단백질을 표적으로 한 마땅한 치료제가 여전히 개발되지 않았다.
GTP 대신 변이 라스 단백질에 달라붙어 활성 구조로 바뀌지 않게 하는 분자를 만들면 해결될 것 같은데 세포 내 GTP 농도가 워낙 높아 이런 식의 경쟁이 되지 않기 때문이다. 결국 변이 라스는 ‘치료제를 만들 수 없는 단백질(undruggable protein)’이라는 반갑지 않은 별명까지 얻었다.
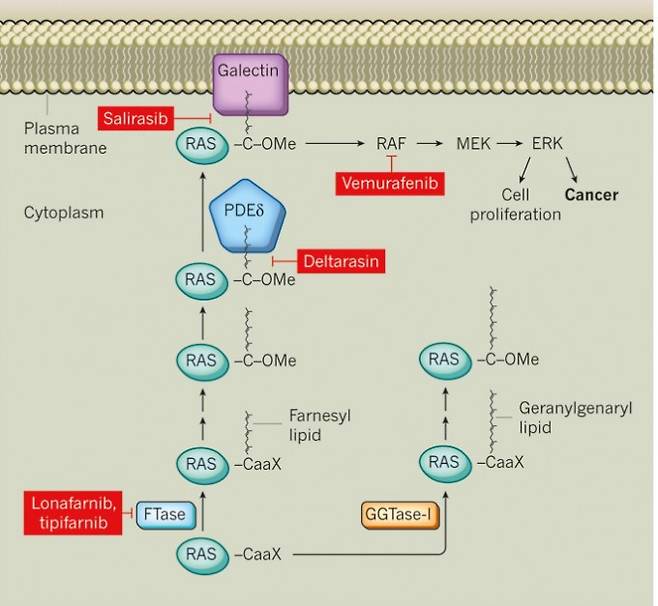
사실 약간의 진전은 있었다. 라스 단백질의 변이는 여러 유형이 있는데 그 가운데 12번째 아미노산 글리신이 시스테인으로 바뀐(G12C) 변이 단백질은 비소세포폐암의 13%, 대장암의 5%에서 관찰된다. 그런데 불활성 상태에서 시스테인의 티올기(-SH)에 결합해 GTP가 달라붙지 못하게 막는 약물 소토라십(Sotorasib)과 아다그라십(adagrasibl)이 개발됐고 각각 2021년과 2022년 G12C 변이 비소세포폐암 치료제로 미국식품의약국(FDA)의 승인을 받았다(각각 제품명 루마크라스(Lumakras)와 크라자티(Krazati)).
라스 단백질이 밝혀지고 거의 40년 만에 이를 표적으로 하는 치료제가 나왔고 효과도 뛰어났지만 아직 갈 길은 멀다. 먼저 이들 약물은 G12C가 아닌 다른 변이 라스 단백질이 있는 암세포에는 효과가 없다. 또 일단 활성화된 단백질에는 효과가 없어 작용 속도가 느리고 내성도 보고되고 있다.
● 라스 표적 범용 치료제 희망
지난 8일 학술지 ‘네이처’ 사이트에는 다양한 변이 라스 단백질을 표적으로 삼을 수 있는 범용 치료제 후보 물질을 소개한 놀라운 논문이 공개됐다. 미국의 암 치료제 개발 회사인 레볼루션메디슨의 연구자들은 다른 단백질을 끌어들여 라스 단백질을 효과적으로 무력화시키는 분자를 만들었다.

아직 이름을 짓지 않아 RMC-7977이라는 일련번호로 불리는 이 분자의 한쪽은 CYPA라는 샤프론 단백질과 달라붙고 다른 한쪽은 활성 변이 라스 단백질에 달라붙는다. 샤프론은 다른 단백질의 구조를 안정하게 하는 역할을 하는 단백질이다. RMC-7977라는 분자 딱풀(molecular glue)로 CYPA와 라스가 가까워지면서 신호를 전달할 단백질이 라스에 접근하지 못해 사실상 꺼진 상태가 된다.
연구자들은 변이 라스 단백질이 있는 암 환자에서 얻은 암세포 100여 가지를 실험동물에 넣어 암을 유발한 뒤 RMC-7977를 적용해 효과를 봤다. 그 결과 다양한 유형의 변이에서 효과가 뛰어났다. G12C 유형에서도 17일 투여 시점에서 소토라십은 암 성장을 47% 억제하는 데 그쳤지만 RMC-7977는 90%나 됐다. 게다가 정상 라스 단백질에 달라붙는 힘이 상대적으로 약해 부작용도 덜한 편이다.
김성호 교수의 제자이자 2001년 김 교수가 예일대 조셉 실레싱어 교수와 같이 만든 회사 플렉시콘(Plexxikon)의 대표로 있으면서 피부암 치료제 베무라페닙(Vemurafenib. 제품명 젤보라프(Zelboraf))를 개발하기도 한 차오 장 박사는 2013년 한 기고문에서 “라스(Ras)를 길들이지 못하면 암과의 전쟁에서 이길 수 없다”고 썼다.
흥미롭게도 베무라페닙의 표적인 변이 RAF 단백질은 라스의 신호 전달 경로에 놓인 효소다. 라스 단백질 구조를 밝힌 실험실 출신으로 변이 라스 단백질을 표적으로 한 치료제 개발에는 끝내 성공하지 못한 장 박사가 이번 논문에 대해서는 어떻게 평가할지 궁금하다.
※ 필자소개
강석기 과학칼럼니스트. LG생활건강연구소에서 연구원으로 근무했고 2000년부터 2012년까지 동아사이언스에서 기자로 일했다. 2012년 9월부터 프리랜서 작가로 활동하고 있다. 지은 책으로 《강석기의 과학카페》(1~10권), 《생명과학의 기원을 찾아서》, 《식물은 어떻게 작물이 되었나》가 있다.
[강석기 과학 칼럼니스트 kangsukki@gmail.com]
Copyright © 동아사이언스. 무단전재 및 재배포 금지.