|
| © News1 DB |
파로스아이바이오가 인공지능(AI) 신약개발 플랫폼 ‘케미버스’로 발굴한 항암 신약 후보물질 ‘PHI-101’이 치료목적사용 승인을 추가로 받았다. PHI-101 임상 1상시험은 순항 중이다. 파로스아이바이오는 임상 2상을 마친 후 결과에 따라 PHI-101의 조기 상용화에 나설 방침이다.
1일 업계에 따르면 식품의약품안전처는 전날 재발성 또는 불응성 급성골수성백혈병(AML)을 앓는 개인 환자를 대상으로 PHI-101을 투약하는 치료목적사용을 승인했다. 투약은 가톨릭대 서울성모병원에서 이뤄진다.AML은 혈액세포를 생성하는 줄기세포인 조혈모세포가 악성세포로 변하는 혈액암이다. 고령층일수록 치료가 어렵고 생존율이 낮으면서 재발률이 높은 암이다.
개인별 환자를 위한 치료목적사용 제도는 임상시험 중인 의약품을 의사의 판단에 따라 환자에게 투약할 수 있도록 길을 열어둔 제도다. 중대한 질환을 앓고 있는 환자에게 투여할 시 위험보다 이익이 크다고 의사가 판단할 때 이용할 수 있는 제도다. 식약처로부터 승인을 받은 후 약물을 투여할 수 있다.
이번 승인은 PHI-101를 치료목적으로 사용하는 3번째 허가다. 앞서 PHI-101은 올해 4월과 8월 각각 악성 흑색종, AML 환자를 대상으로 연세대 세브란스병원과 가톨릭대 성모병원에서 치료목적사용 승인을 받았다.
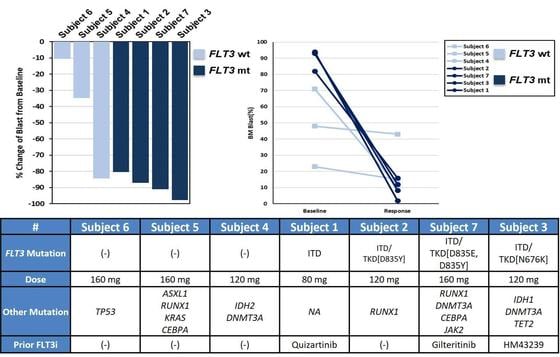 |
| 급성골수성백혈병 대상 PHI-101 임상 1상a시험 중간결과.(자료 금융감독원) |
PHI-101은 AML, 난소암을 대상으로 개발 중인 먹는(경구용) 항암 신약 후보물질이다. 파로스아이바이오가 보유한 AI신약개발 플랫폼 케미버스의 심장 독성 예측을 통해 선정된 후보물질이다.
PHI-101은 AML 환자에서 나타나는 주된 돌연변이인 FLT3 돌연변이를 표적한다. FLT3 저항성 돌연변이 동물모델로 연구한 동물시험에서 경쟁 약물 대비 우월한 종양 성장 억제 효능을 보였다. 우리나라와 호주에서 진행된 임상 1a상에서 용량제한독성이 관측되지 않았다. 1주기(28일) 복용 후 AML 환자들의 골수악성세포를 70%가량 감소시켰다.
PHI-101 임상은 우리나라와 호주에서 AML을 대상으로 1b상이 진행되고 있다. 난소암을 대상으로는 우리나라에서 1상이 이뤄지고 있다.
PHI-101 임상 개발 총괄 책임자는 윤성수 서울대병원 혈액종양내과 교수다. 도널드 스몰 존스홉킨스 의대 교수가 임상시험 설계에 참여했다. 도널드 스몰 교수는 FLT3 표적단백질의 활성검증법 등을 개발한 전문가다.
PH-101 원료는 선진의약품제조및품질관리기준(cGMP) 인증을 받은 에스티팜에서 생산된다. cGMP 시설을 갖춘 파테온에서 PHI-101 경구제를 제조하고 있다.
PHI0191은 2019년 미국 식품의약국(FDA)으로부터 희귀의약품으로 지정받았다. 희귀의약품으로 지정을 받으면 심사 수수료 면제, 우선심사 등의 혜택을 받을 수 있다.
파로스아이바이오는 임상 2상 후 조건부 품목허가를 통해 PHI-101을 조기에 상용화할 계획이다. 동시에 기술이전도 추진할 방침이다.
파로스아이바이오 관계자는 “PHI-101은 FLT3 저해제 복용으로 호전되지 않았거나 재발한 환자에서 골수악성세포 감소효과 등이 확인됐다”면서 “기존 FLT3 저해제의 약점을 극복하는 차세대 계열내최고(Best-in-class) FLT3 저해제가 될 것으로 기대하고 있다”고 했다.
jin@news1.kr











![뉴진스, 하이브 vs 민희진 분쟁 후 첫 무대…미소 가득 [N컷]](https://image.news1.kr/system/photos/2024/5/21/6662089/no_water.jpg/dims/resize/276/crop/276x184/thumbnail/138x92!/optimize)
![장다아, 동생 장원영과 닮은 듯 다른 얼굴 [N화보]](https://image.news1.kr/system/photos/2024/5/21/6659963/no_water.jpg/dims/resize/276/crop/276x184/thumbnail/138x92!/optimize)