코로나19 진단시약 국내 승인, 수출용 15분1에 불과..왜?
국내 승인 문턱 높은데 비용 대비 효용 적다는 평가
국내 코로나19 진단시장, 긴급사용승인 PCR업체 선점
![[이데일리 방인권 기자]](https://img4.daumcdn.net/thumb/R658x0.q70/?fname=https://t1.daumcdn.net/news/202101/28/Edaily/20210128174839505tals.jpg)
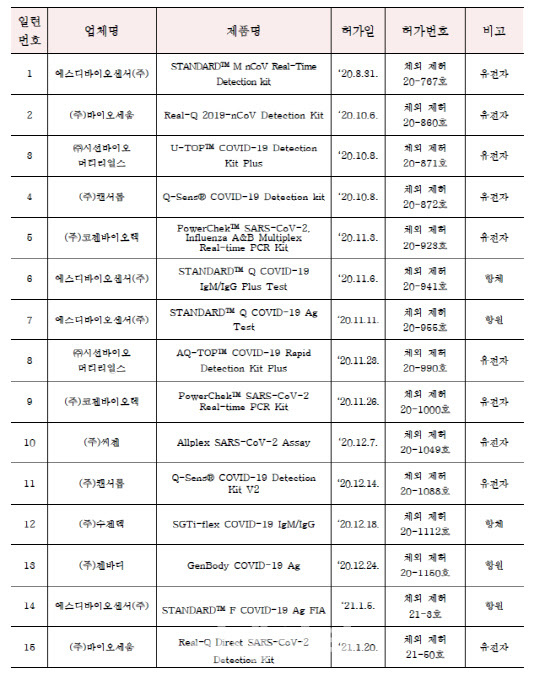
28일 식품의약품안전체에 따르면, 국내에서 코로나19 진단시약으로 정식허가를 받은 제품은 지난 26일 현재 모두 17개다. 해당 업체는 에스디바이오센서(5개)를 비롯해 바이오세움(2개), 시선바이오머티리얼스(2개) 캔서롭(2개), 코젠바이오텍(2개), 씨젠(2개), 수젠텍(1개), 젠바디(1개) 등 8곳에 불과하다. 반면 27일 기준 코로나19 진단시약 수출용 허가를 받은 제품은 총 253개다. 수출용 코로나19 진단시약 허가가 15배 가량(제품기준) 많은 셈이다.
국내 정식허가 제품이 수출용에 견줘 적은 것은 국내 코로나19 진단시장이 초기에 긴급사용승인을 받은 PCR 방식 키트 위주로 형성돼 후발 주자가 진입하기 쉽지 않기 때문이라는 분석이다. 한 진단키트 회사 대표는 “국내 시장은 한정적인데 초기 긴급사용승인을 받은 몇 개 제품이 병원 등에 다 깔렸다”며 “병원에서도 잘 쓰던 제품을 다른 제품으로 바꿀 이유가 거의 없어 후발주자가 시장에 진입하기 어렵다”고 말했다.
초기 국내 코로나19 사태 당시 긴급사용 승인을 받은 진단키트는 지난해 2월 초 코젠바이오텍을 시작으로 씨젠(096530)(2월), 솔젠트(2월), 에스디바이오센서(2월), 바이오세움(3월), 바이오코아(5월), 웰스바이오(5월) 등 7개 제품이었다. 모두 PCR 방식 제품이다. 질병관리청은 세계보건기구(WHO)가 권고하는 대로 코로나19 확증 검사에 PCR 방식 검사만을 사용했고 긴급사용승인 역시 PCR 방식 키트에만 허용했다. 항체나 항원진단은 개별 제품에 따라 다르지만 일반적으로 정확도가 떨어진다는 이유에서다. 대한진단검사의학회에서도 분자 진단검사 방법이 전 세계에서 코로나19 확진에 사용하는 ‘표준’이라고 봤다.
![[이데일리 방인권 기자]](https://img1.daumcdn.net/thumb/R658x0.q70/?fname=https://t1.daumcdn.net/news/202101/28/Edaily/20210128174840855uewg.jpg)
여기에 코로나19 진단키트의 국내 정식사용 승인이 수출허가에 비해 문턱이 높아 개발 기업에서는 정식허가 승인을 받을 유인이 적다는 분석이다. 식약처에 따르면, 코로나19 수출허가의 경우 제품 성능을 확인하기 위한 임상시험 자료와 분석적 성능시험 자료가 약식자료로도 가능하다. 식약처 관계자는 “수출허가는 최소 검체 샘플수에 제한이 없고 통상 20개 안팎의 샘플만 있어도 되지만 정식허가는 수백개가 필요하다”며 “수출 허가는 해당 나라에서 별도로 심사를 받기 때문에 최소한의 필요 요건만 심사한다”고 말했다. 식약처 심사처리기한을 봐도 정식허가는 80일인 반면 수출허가는 10일에 그친다.
다른 진단업체 대표는 “국내 정식허가 승인은 미국 식품의약국(FDA)의 긴급사용승인(EUA)과 비슷한 수준이라고 보면 된다”며 “진단키트를 오랫동안 만들어보고 허가 경험도 있는 곳이 아니면 받기 쉽지 않다”고 말했다. 식약처에 따르면 국내 업체에서 코로나19 진단키트의 FDA 긴급사용승인을 받은 곳은 지난해 4월 오상헬스케어를 시작으로 씨젠, SD바이오센서, 랩지노믹스(084650), 솔젠트, 수젠텍(253840) 등 20곳(27일 기준)에 그친다. 결국 코로나19 진단키트 국내 허가는 받기는 어려운데 제품을 팔 국내 시장이 제한적이라 유용성이 떨어진다는 얘기다.
다만, 최근 해외에서도 수출허가를 내줄 때 국내 정식허가 획득을 요구하는 곳이 늘어나고 있는 것으로 알려졌다. 또다른 진단업체 대표는 “동남아 러시아 등에서 국내 사용승인 요건을 요구하는 곳이 늘고 있다”며 “일종의 가산점 같은 항목으로 국내 사용승인 여부가 영향을 주고 있다”고 설명했다. 국내 시장 판매용이 아니라 해외 수출 판로를 뚫기 위해 국내 허가를 받는 수요가 있을 수 있다는 취지다.

노희준 (gurazip@edaily.co.kr)
Copyright © 이데일리. 무단전재 및 재배포 금지.
- [단독]4차 재난지원금 '최소 15조' 사상최대…코로나 무풍지대 공무원은 제외
- [단독] '군 특혜 의혹' 안승남 구리시장 아들은 배우 A씨
- 우상호 "은마아파트 안타깝다는 나경원, 23만 반지하 서민 눈물은..."
- 故 송유정 소속사 써브라임아티스트 측 "가세연 명예훼손으로 고소" [공식]
- 이성미 "미투하면.. 죽었던 놈도 일어나야 한다"
- "구경났나" 기자 휴대폰 빼앗은 조수진…논란 일자 결국 사과
- 정은경 "백신 가장 우려하는 점은 '심한 쇼크' 반응"
- BJ 감스트 "실종 아니에요"
- 한예리, '미나리'로 골드리스트 여우주연상
- 정 총리 “담뱃값 8천원 인상 계획 없다…단기간내 추진 못해”(종합)